Перейти к:
Вагинальный и эндометриальный микробиом: оценка, влияние на имплантацию эмбриона
https://doi.org/10.21886/2219-8075-2023-14-3-5-15
Аннотация
Цель: оценка микробиома влагалища и полости матки с использованием маточного катетера с цанговой направляющей у инфертильных пациенток перед проведением процедуры экстракорпорального оплодотворения. Материалы и методы: были взяты и изучены образцы вагинального и эндометриального соскобов, полученные от 73 инфертильных женщин, запланировавших процедуру экстракорпорального оплодотворения (ЭКО). Образцы были проанализированы областями V3-V4-V6 с помощью метода секвенирования гена 16S рРНК. Результаты: обнаружены существенные различия в таксономии эндометрия и вагинального микробиома. Совпадения по микробиологическому составу выявлены у 18,2% пациенток. Эндометриальные лактобацилло-доминантные микробиоценозы встречались у 24,8% женщин, вагинальные — у 56,7%. Сравнение между пациентками с отрицательными и положительными результатами ЭКО (наступление биологической беременности) не смогло идентифицировать какой-либо микроорганизм, связанный с успехом процедуры, при этом биоразнообразие микробиоты эндометрия было выше среди женщин, успешно реализовавших свою репродуктивную функцию. Индекс равноправия Шеннона (J) у беременных и небеременных женщин составил 0,76 (0,57–0,87) и 0,55 (0,51–0,64) соответственно (p=0,002). Заключение: использование разработанного маточного катетера с цанговой направляющей для адекватной оценки микробиома эндометрия является перспективным и обоснованным. Правильная оценка эндометриального микробиоценоза способствует адекватной диагностике патологических процессов, происходящих в полости матки, что позволит провести правильную терапию, направленную на повышение рецептивности эндометрия и в дальнейшем способствовать реализации репродуктивной функции женщины.
Ключевые слова
Для цитирования:
Куценко И.И., Боровиков И.О., Кравцова Е.И., Булгакова В.П., Боровикова О.И., Черемных Р.В., Андреева А.А., Боровиков М.И. Вагинальный и эндометриальный микробиом: оценка, влияние на имплантацию эмбриона. Медицинский вестник Юга России. 2023;14(3):5-15. https://doi.org/10.21886/2219-8075-2023-14-3-5-15
For citation:
Kutsenko I.I., Borovikov I.O., Kravtsova E.I., Bulgakova V.P., Borovikova O.I., Cheremnykh R.V., Andreeva A.A., Borovikov M.I. Vaginal and endometrial microbiome: evaluation, effect on embryo implantation. Medical Herald of the South of Russia. 2023;14(3):5-15. (In Russ.) https://doi.org/10.21886/2219-8075-2023-14-3-5-15
Введение
Репродуктивный микробиом является новой темой в области акушерства и гинекологии [1–6]. В частности, особый интерес представляет микробиом полости матки, а именно эндометрия — анатомической ниши, где микроорганизмы с низким содержанием биомассы могут модулировать местную иммунную среду [7]. Интерес в первую очередь обусловлен влиянием микробиоты на имплантацию эмбриона и формирование плаценты, что потенциально влияет на фертильность и развитие акушерских осложнений [2][4][8][9]. Недавние исследования показали, что в контексте экстракорпорального оплодотворения (ЭКО) микробиота эндометрия, в которой не доминируют лактобациллы (определяемая как <90% Lactobacillus spp.) была связана со значительным снижением показателей имплантации, беременности и живорождений [10–12].
Основанные на секвенировании методы обнаружения бактерий в настоящее время являются краеугольным камнем оценки микробиома в анатомических участках с низкой биомассой. Эти методы метабаркодирования основаны на амплификации и секвенировании бактериального гена рибосомальной РНК 16S (рРНК), содержащего девять гипервариабельных областей (V1-V9), что позволяет различать и количественно оценивать различные виды микробов, присутствующие в конкретном образце [13–15]. Существенным ограничением в исследовании эндометриального микробиома являются применяемые в настоящее время методы забора проб для его анализа, которым до сих пор не уделяется достаточного внимания. При этом данные процедуры обладают одним общим недостатком, а именно возможностью контаминации образцов эндометрия цервикальными или вагинальными микроорганизмами, то есть контаминацией из анатомических областей с высокой биомассой и плотностью микроорганизмов (на 107 и 105 и выше, чем в эндометрии), что может полностью нивелировать результаты исследований [4][10][16]. Соответственно проведенные исследования, изучавшие микробиом эндометрия с использованием трансцервикального катетера для отбора проб и исследования с использованием гистообразца эндометрия, полученного при гистерэктомии и достигающего полости эндометрия, показали радикально разные результаты как с точки зрения плотности микроорганизмов, так и колонизирующих видов [1][17–20].
В настоящем исследовании мы предлагаем для получения образцов эндометрия и оценки микробиоты использовать двуполостные маточные катетеры с цанговой направляющей собственной модификации, обычно используемые для переноса эмбрионов. Ожидается, что эта система маточного катетера уменьшит возможную контаминацию микроорганизмами шейки матки и влагалища. Чтобы исследовать достоверность этой модальности сбора образцов, мы сравнили микробиоты эндометрия и влагалища у инфертильных женщин, запланировавших процедуру ЭКО и перенос замороженных эмбрионов. В качестве вторичной цели мы также оценили связь полученной микробиоты с последующей вероятностью беременности.
Цель исследования — оценка микробиома влагалища и полости матки с использованием маточного катетера с цанговой направляющей у инфертильных пациенток перед проведением процедуры экстракорпорального оплодотворения.
Материалы и методы
В исследования участвовало 73 женщины (средний возраст — 34,1±3,7 лет) с инфертильностью перед подготовкой к циклу ЭКО или интрацитоплазматической инъекции сперматозоидов (ИКСИ), имеющие бластоцисты для криопереноса в 5 центрах репродукции г. Краснодара (Клиника Кубанского государственного медицинского университета (КубГМУ), центр планирования семьи Краевого перинатального центра Детской краевой клинической больницы (ДККБ), центр репродукции клиники «Екатерининская», клиника мужского и женского здоровья «OXY-center», клиника репродукции «Эмбрио») в период с 01.2021 по 01.2023 гг. (табл. 1).
Таблица / Table 1
Исходная характеристика пациенток
Initial characteristics of patients
|
Данные / data |
n=73 |
ДИ / IQR; % |
|
Возраст (лет) / age (years) |
34,1 |
27–38 |
|
ИМТ / BMI (kg/m²) |
26,3 |
19,9–28,2 |
|
Курение / smoking |
17 |
23,3 |
|
АМГ / AMG (ng/ml) |
2,34 |
2,23–3,65 |
|
Предыдущая беременность / previous pregnancy |
55 |
75,3 |
|
Предыдущие живорождения / previous live births |
32 |
43,8 |
|
Продолжительность бесплодия (лет) / duration of infertility (years) |
3 |
2–7 |
|
Причина бесплодия / cause of infertility |
||
|
Мужской фактор / male factor |
9 |
12,3 |
|
Трубный фактор / pipe factor |
7 |
9,6 |
|
Эндометриоз / endometriosis |
11 |
15,1 |
|
Идиопатическое бесплодие / idiopathic infertility |
37 |
50,7 |
|
Смешанный / mixed |
9 |
12,3 |
|
Количество попыток ЭКО / number of IVF attempts |
||
|
1 |
5 |
6,8 |
|
2 |
11 |
15,1 |
|
≥3 |
57 |
78,1 |
|
Подготовка эндометрия к переносу / preparation of the endometrium for transfer |
||
|
ЗГТ / HRT |
21 |
28,8 |
|
Природный цикл / natural cycle |
52 |
71,2 |
Критерии исключения: 1) текущий диагноз «Воспалительное заболевание органов малого таза» (ВЗОМТ); 2) наличие гидросальпинкса; 3) клинически значимые аномалии полости эндометрия, включая миому, полипы эндометрия и маточную перегородку, синдром Ашермана; 4) проведённая в течение последнего месяца антибактериальная терапия; 5) гормональное лечение (прогестины, эстропрогестины или гонадотропины) в течение последнего месяца; 6) аномальное маточное кровотечение; 7) перенос эмбрионов, запланированный в том же менструальном цикле. Женщины, согласившиеся на участие, были проинформированы о цели исследования, возможном дискомфорте процедуры и возможных рисках и подписали информированное согласие.
Образцы из полости матки для микробиологического исследования брались у женщин, находящихся в литотомическом положении на гинекологическом кресле с осмотром в зеркалах (типа Куско) между 15 и 25 днями естественного менструального цикла. Отбор проб производился с трансабдоминальной ультразвуковой визуализацией. Сначала брался образец вагинальной микрофлоры с заднего свода влагалища (стерильный тампон), затем, после удаления цервикальной слизи стерильным тампоном, максимально избегая контакта со стенками влагалища и нестерильными поверхностями, вводился маточный двухпросветный цанговый зонд, проводился забор материала эндометрия, после чего проводилось закрытие цанги и зонд извлекался (рис. 1).

Рисунок 1. Маточный двухпросветный цанговый зонд для отбора проб эндометрия
Figure 1. Uterine double-lumen collet probe for endometrial sampling
Примечание: наружный полый катетер (представленный серым цветом)
совмещается с дистальной цервикального канала, затем, после раскрытия цанги,
внутренний зонд с меньшим диаметром (представленный синим цветом)
проходит через первый и собирает соскоб эндометрия,
избегая контактов со слизистыми оболочками влагалища и шейки матки
(приоритетная справка на изобретение №2022127503/14(060304) от 21.10.2022).
Note: the outer hollow catheter (represented in gray)
is combined with the distal cervical canal, then, after the opening of the collet,
an internal probe with a smaller diameter (represented in blue)
passes through the first and collects the scraping of the endometrium,
avoiding contact with the mucous membranes of the vagina and cervix
(priority reference for invention No. 2022127503/14 (060304) of 21.10.2022).
Содержимое зонда суспендировали в 150 мкл стерильного физиологического раствора, предварительно приготовленного в 1 мл стерильной пробирки Эппeндорфа, затем дистальную часть катетера (2–3 мм) отламывали и опускали внутрь пробирки вместе с физиологическим раствором (пробирку хранили при температуре −80°C).
На момент оценки образцы из влагалища и полости матки размораживали и выделяли бактериальную ДНК для её исследования методом ПЦР в реальном времени (ПЦР-РВ) с использованием набора реагентов «Фемофлор-16» (ООО «НПО ДНК-Технология», РФ): ДНК выделяли из 100 мкл пробы с использованием набора реагентов «Проба-ГС». Этот тест позволяет одновременно амплифицировать и обнаруживать целевые нуклеиновые кислоты микрофлоры, ассоциированной с бактериальным вагинозом: Gardnerella vaginalis, Atopobium vaginae, Megasphaera, Mobiluncus spp., Bacteroides fragilis, а также Lactobacillus spp. (L. crispatus, L. gasseri, L. jensenii). Анализ обеспечивает автоматическую интерпретацию микрофлоры с использованием количественного анализа.
Секвенирование 16S рРНК бактериальных генов выполняли с использованием набора раствора микробиоты B для гипервариабельных областей V3-V4-V6 путём использования дегенеративных праймеров, включающих в себя 2 исследования: EMMA® (Endometrial Microbiome Metagenomic Analysis — анализ микрофлоры эндометрия для оценки репродуктивного прогноза) и ALICE® (Analysis of Infectious Chronic Endometritis — анализ патогенной микрофлоры эндометрия («Igenomix», Spain)) [14][15]. Полученная амплификация гипервариабельных областей V3–V4–V6 позволяет идентифицировать большинство бактериальных популяций, присутствующих в микробиоте. Данные секвенирования анализировались автоматически с помощью программного обеспечения MicrobAT (Microbiota analysis Tool, Igenomix, Spain), предоставляющего отчёт для каждого образца с назначением операционных таксономических единиц (OTU).
Данные анализировались с помощью программного обеспечения Statistical Package for Social Sciences (SPSS 23.0, IL, США). Данные были представлены как число (%), среднее ± SD или медиана (межквартильный диапазон (interquartile range) — IQR). Сравнения проводились с использованием T-критерия Стьюдента, непараметрического критерия Фишера (значения p<0,05 считались статистически значимыми). Относительная доля различных бактериальных родов была рассчитана с использованием в качестве знаменателя только общего числа информативных считываний. Микробиом эндометрия считался лактобацилло-доминантным, если относительное содержание Lactobacillus превышало 90%. Индекс Шеннона (SH) и индекс эквивалентности Шеннона был рассчитан программным обеспечением MicrobAT.
Исследование было одобрено Этическим комитетом КубГМУ (протокол №17 от 12.01.2021) и проводилось в соответствии с Хельсинкской декларацией (пересмотр 2013, Бразилия), правилами Надлежащей клинической практики (GCP; 2016, Астана) и клинической практики в РФ (приказ МЗ РФ №200н, 2016). Обследование пациенток проводилось согласно приказам МЗ РФ №1130н от 20.10.2020 г. «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология», №803н от 31.07.2020 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению», клиническим рекомендациям «Женское бесплодие» (2021).
Результаты
Межквартильный диапазон (IQR) — общее число показаний последовательностей для эндометрия и вагинальных образцов составило 2583 (385–6083) и 3822 (910–6920) соответственно, IQR-индексы Шеннона для них составили 2,73 (2,49–3,17) и 1,70 (1,44–2,22) (p<0,001), IQR-индексы эквитабельности Шеннона — 0,57 (0,52–0,74) и 0,44 (0,40–0,53) (p<0,001). Преобладание лактобациллярной микрофлоры отмечено в 30,1% (22/73) эндометриальных и 53,4% (39/73) вагинальных образцов; у 86,3% (19/22) женщин, у которых Lactobacillus spp. был наиболее распространённым видом в образцах эндометрия, также имели Lactobacillus в качестве наиболее распространённого вида во влагалищных образцах. Пациентки, микрофлору которых можно было классифицировать как Lactobacillus-dominantus (Lactobacillus >90%), выявлены в 8,2% (6/73) эндометриальных и 41,1% (30/73) вагинальных образцов (индекс корреляции Спирмена между долей Lactobacillus spp. в эндометриальных и вагинальных образцах составил Rho=0,53, p<0,001 — слабая корреляция) (табл. 2).
Таблица / Table 2
Наиболее распространённые роды бактерий в микробиоте эндометрия и влагалища
The most common types of bacteria in the endometrial and vaginal microbiota
|
Место Place |
Вид Species |
Встречаемость Prevalence >1% |
Встречаемость Prevalence (%; ди) |
Наиболее часто встречаемые роды Most prevalent species |
Доминирующие роды Dominant species (>90%) |
|
endometrium |
Lactobacillus |
61 (83,6%) |
13 (3-37) |
22 (30,1%) |
6 (8,2%) |
|
Propionibacterium |
54 (74,0%) |
7 (4-14) |
3 (4,1%) |
0 (0,0%) |
|
|
Pelomonas |
51 (69,9%) |
6 (2-9) |
6 (8,2%) |
0 (0,0%) |
|
|
Pseudomonas |
46 (63,0%) |
8 (2-14) |
4 (5,5%) |
0 (0,0%) |
|
|
Streptococcus |
38 (52,0%) |
2 (1-3) |
2 (2,7%) |
0 (0,0%) |
|
|
Escherichia coli |
37 (50,7%) |
4 (1-11) |
6 (8,2%) |
3 (4,1%) |
|
|
vagina |
Lactobacillus |
68 (93,1%) |
83 (27-99) |
39 (53,4%) |
30 (41,1%) |
|
Gardnerella |
23 (31,5%) |
31 (15-62) |
11 (15,1%) |
4 (5,5%) |
|
|
Bifidobacterium |
17 (23,3%) |
50 (8-87) |
9 (12,3%) |
5 (6,8%) |
Доминантные бактериальные роды микробиоты эндометрия и влагалища совпали только у 9,6% (7/73) женщин. Для эндометрия наиболее распространёнными бактериальными родами были Lactobacillus, Pelomonas, Propionibacterium, Pseudomonas, Streptococcus и Escherichia coli (табл. 2-3). Для влагалища это были Lactobacillus, Gardnerella и Bifidobacterium.
Таблица / Table 3
Сравнительные результаты микробиоты эндометрия
Comparative results of the endometrial microbiota
|
Пациент Patient №№ |
PCR-RT (femoflor-16®) |
rRNA 16s (EMMA®; ALICE®) |
|
Отрицательный исход ЭКО Negative outcome of IVF |
||
|
1 |
Lactobacillus spp. |
Lactobacillus spp. Enterococcus spp. |
|
2 |
Lactobacillus spp., E. coli |
Lactobacillus spp., E. coli |
|
3 |
Mycoplasma hominis |
Lactobacillus spp. |
|
4 |
Lactobacillus spp., Streptococcus spp. |
E. coli, Bifidobacterium, Prevotella |
|
5 |
Lactobacillus spp., Candida albicans |
Lactobacillus spp., Staphylococcus |
|
6 |
Lactobacillus spp. |
Lactobacillus spp., Propionibacterium |
|
7 |
Lactobacillus spp. |
Lactobacillus spp., Enterococcus spp. |
|
8 |
negative |
Streptococcus, Pelomonas |
|
9 |
Lactobacillus spp. |
Streptococcus |
|
10 |
Lactobacillus spp. |
Lactobacillus spp., Propionibacterium |
|
11 |
Streptococcus spp. |
Mеgasphaera |
|
12 |
Candida albicans |
Enterococcus spp., Streptococcus |
|
13 |
Lactobacillus spp., Staphylococcus spp. |
Lactobacillus spp. |
|
14 |
negative |
Bifidobacterium |
|
15 |
Lactobacillus spp., E. coli, Pelomonas |
Lactobacillus spp., E. coli, Staphylococcus |
|
16 |
negative |
Lactobacillus spp., Pelomonas |
|
17 |
Lactobacillus spp. |
negative |
|
18 |
Lactobacillus spp.., Enterococcus spp. |
Lactobacillus spp., Mеgasphaera |
|
19 |
Lactobacillus spp. |
Lactobacillus spp. |
|
20 |
Lactobacillus spp. |
Lactobacillus spp. |
|
21 |
E. coli, Enterococcus spp., Ureaplasma |
Bifidobacterium |
|
22 |
negative |
Lactobacillus spp. |
|
23 |
Lactobacillus spp., E. coli |
Klebsiella |
|
24 |
Lactobacillus spp. |
Lactobacillus spp. |
|
25 |
Lactobacillus spp. |
Mеgasphaera |
|
26 |
Lactobacillus spp. |
Lactobacillus spp., Propionibacterium |
|
27 |
Staph. spp., Candida albicans |
Lactobacillus spp., Staphylococcus |
|
28 |
Lactobacillus spp. |
Lactobacillus spp. |
|
29 |
Lactobacillus spp., Staph. spp. |
Lactobacillus spp. |
|
30 |
Lactobacillus spp. |
Lactobacillus spp., Bifidobacterium |
|
31 |
Lactobacillus spp., Enterobacteriaceae |
Propionibacterium |
|
32 |
Lactobacillus spp. |
negative |
|
33 |
Lactobacillus spp., C. albicans |
Lactobacillus spp., Bifidobacterium |
|
34 |
negative |
Prevotella |
|
35 |
Lactobacillus spp. |
Lactobacillus spp. |
|
36 |
Lactobacillus spp. |
Lactobacillus spp. |
|
37 |
G. vaginalis, Pelomonas |
Propionibacterium, Pelomonas |
|
38 |
negative |
Lactobacillus spp., Prevotella |
|
39 |
Lactobacillus spp. |
Veillonella |
|
40 |
Lactobacillus spp. |
Lactobacillus spp. |
|
41 |
Lactobacillus spp., E. coli |
negative |
|
42 |
Lactobacillus spp. |
Lactobacillus spp. |
|
43 |
Lactobacillus spp., Enterobacteriaceae |
Lactobacillus spp., Enterococcus spp. |
|
44 |
Lactobacillus spp. |
Lactobacillus spp., Propionibacterium |
|
45 |
Lactobacillus spp., Pelomonas |
Mеgasphaera |
|
46 |
Lactobacillus spp. |
Lactobacillus spp. |
|
47 |
Lactobacillus spp., Ureaplasma |
Lactobacillus spp. |
|
48 |
Lactobacillus spp. |
negative |
|
49 |
Lactobacillus spp., E. coli |
Lactobacillus spp., Veillonella |
|
50 |
Lactobacillus spp. |
Lactobacillus spp. |
|
Положительный исход ЭКО (клиническая беременность) Positive outcome of IVF (clinical pregnancy) |
||
|
51 |
Lactobacillus spp., Strept. spp. |
Lactobacillus spp., Streptococcus |
|
52 |
Lactobacillus spp., Pelomonas |
Staphylococcus |
|
53 |
Lactobacillus spp. |
Lactobacillus spp., Propionibacterium |
|
54 |
Streptococcus spp., Pelomonas |
Streptococcus, Mеgasphaera |
|
55 |
Enterococcus spp., Candida albicans |
Enterococcus spp., Streptococcus |
|
56 |
Lactobacillus spp., Staphylococcus spp |
Lactobacillus spp. |
|
57 |
Enterococcus spp., Ureaplasma |
Enterococcus spp., Bifidobacterium |
|
58 |
Lactobacillus spp., E. coli, Staph. spp. |
Lactobacillus spp., Staphylococcus |
|
59 |
Ureaplasma, Candida albicans |
Lactobacillus spp., Prevotella |
|
60 |
Lactobacillus spp. |
Lactobacillus spp. |
|
61 |
Lactobacillus spp.., Enterococcus spp. |
Lactobacillus spp., Mеgasphaera |
|
62 |
Lactobacillus spp. |
Pelomonas |
|
63 |
Lactobacillus spp. |
Lactobacillus spp. |
|
64 |
Lactobacillus spp., Pelomonas |
Bifidobacterium |
|
65 |
Lactobacillus spp. |
Lactobacillus spp. |
|
66 |
E. coli, Pelomonas |
Lactobacillus spp., Pelomonas |
|
67 |
Lactobacillus spp. |
Lactobacillus spp. |
|
68 |
Staph. spp., Candida albicans |
Lactobacillus spp., Staphylococcus |
|
69 |
Lactobacillus spp. |
Lactobacillus spp. |
|
70 |
Lactobacillus spp., Staph. spp. |
negative |
|
71 |
Lactobacillus spp. |
Lactobacillus spp., Bifidobacterium |
|
72 |
Lactobacillus spp., Enterobacteriaceae |
Propionibacterium |
|
73 |
Lactobacillus spp. |
Lactobacillus spp. |
При этом данные мультиплексной ПЦР-РВ в эндометриальных образцах существенно не совпадали с результатами 16sрРНК секвенирования, что представляется логичным, так как система ПЦР-детекции в первую очередь направлена на обнаружение микрофлоры, ответственной за развитие бактериального вагиноза и не является тропной к эндометрию (табл. 3).
Результаты
Далее 89,0% (65/73) пациенткам произведён перенос размороженных эмбрионов 3–5 дня (8 женщинам перенос был отменён, так как не была достигнута оптимальная толщина эндометрия). Регистрировалась лишь клиническая беременность (визуализация сердечной деятельности на 6-й неделе), которая наблюдалась у 31,5% (23/73) женщин, живорождение — у 24,7% (18/73) пациенток (у 5,5% (4/73) произошел самопроизвольный выкидыш, у 6,8% (5/73) —преждевременные роды (22–36 недель гестации), остальные 19,2% (14/73) родоразрешены в доношенном сроке беременности).
Из 23 женщин с успешным результатом ЭКО (параметр — наступившая клиническая беременность) преобладание лактобациллярной микрофлоры в эндометриальных и вагинальных пробах было отмечено у 11 (47,8%) – 2 (8,7%) в эндометрии и 9 (39,1%) — во влагалище (p=0,16). При этом не отмечено существенных различий между группами с положительным и отрицательным результатами ЭКО: индекс Шеннона для образцов эндометрия между беременными и небеременными женщинами составил 2,41 (1,12–3,90) и 3,29 (2,84–3,82) (p=0,036) соответственно, индекс эквитабельности Шеннона — 0,76 (0,57–0,87) и 0,55 (0,51–0,64) (p=0,002), что может свидетельствовать о более высоком биоразнообразии в связи с установлением беременности, но, учитывая количество выборки, не является достоверным (рис. 1–2).

Рисунок 2. Индекс Шеннона в образцах эндометрия
Figure 2. Shannon index in endometrial samples
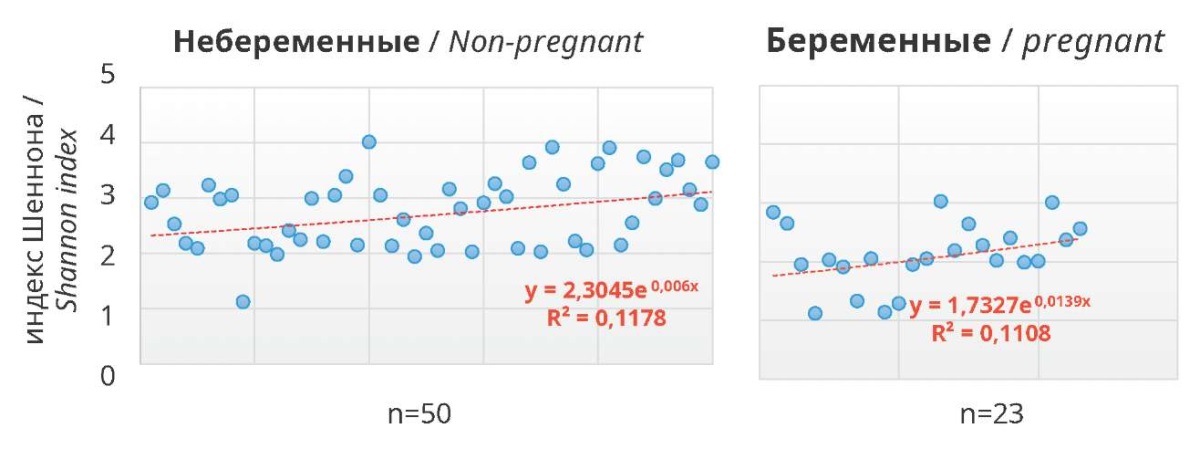
Рисунок 3. Индекс Шеннона в вагинальных образцах
Figure 3. Shannon index in vaginal samples
Статистически значимая разница выявилась для обоих индексов в микробиомах эндометрия (p=0,036 и p=0,002 соответственно), и, наоборот, никаких существенных различий для вагинальных микробиомов не наблюдалось.
Обсуждение
Небеременные результаты данного исследования с использованием авторского метода получения проб эндометрия позволили выявить существенные различия в таксономии между составом эндометрия и вагинального микробиома, что подтверждает его обоснованность. При этом не получено подтверждения о выраженном положительном влиянии доминирования лактобациллярной микрофлоры эндометрия на успех ЭКО, как и об отрицательном влиянии условно-патогенной флоры, ответственной за развитие локальных генитальных дисбиозов. Интересно, что мы наблюдали более высокие показатели индексов Шеннона среди женщин с положительным результатом переноса эмбриона (наступления клинической беременности).
Влагалище и шейка матки являются областями с высоким содержанием биомассы, что обусловливает в большинстве случаев значительную контаминацию биоматериала при их прохождении (концентрация микроорганизмов в шейке матки оценивается, как в 105 более высокое, чем в эндометрии), что и является существенным ограничением в оценке эндометриального микробиоценоза, что и обусловливает актуальность поиска новых методов трансцервикального сбора биоматериала [10]. При этом наша оценка состава микробиома эндометрия и влагалища и, что особенно важно, оценка её влияния на результативность программ ЭКО, во многом отличается от данных других исследователей [1]. При этом как нами, так и большинством авторов не ставится под сомнение сходство между вагинальным и эндометриальным микробиоценозом, что обусловлено их взаимозависимостью и близостью расположения, но, по нашему мнению, наблюдение различий является доводом в пользу точности нашей техники отбора проб.
До настоящего времени в клинической практике были попытки преодолеть контаминацию цервико-вагинальным содержимым образцов эндометрия. Liu et al. (2019) использовали катетер с двойной оболочкой для получения образца эндометрия [21]. Зарегистрированные ими результаты о более выраженной контаминации эндометрия по сравнению с вагинальными образцами Lactobacillus неоднозначны. При этом другие исследователи (Carosso et al., 2020), которые использовали двухпросветные катетеры для переноса эмбрионов, показали среднюю частоту Lactobacillus (27%), что корреспондирует с результатами большинства исследований [22]. Так, Verstraelen et al. (2016) использовали трансцервикальное устройство с силиконовой щеточкой в оболочке и предназначенное для сбора гистообразцов эндометрия и не смогли показать доминирование Lactobacillus в его микробиоме, при этом сообщается о довольно «грубом» воздействии данной цитощетки, нарушающей целостность эндометрия [23]. Qiu et al. (2021) которые выполняли с целью обхода контаминации гистероскопический забор образцов, сообщали о еще более низкой частоте обнаружения Lactobacillus — 7% (существенным недостатком данного метода является его сложность и инвазивность) [24]. Таким образом, до настоящего времени наиболее успешным было использование двухпросветных катетеров для переноса эмбрионов [25][26]. Но при этом методе всё же существует риск загрязнения при прохождении внутреннего катетера через наружный. Используемая нами модель за счёт открытия/закрытия цангового механизма помогает преодолеть этот риск.
Также мы попытались провести параллели между составом микробиома эндометрия и результативностью ЭКО, но полученные результаты имели некоторый контраст с другими исследованиями [12]. Особое значение имеет скудная частота лактобацилл-доминантных случаев у наших пациенток и отсутствие связи состава эндометриальной микробиоты с результатами ЭКО. При этом результаты данного исследования не ставят под сомнение выводы Moreno et al. (2016) о связи доминирования лактофлоры и положительным результатом, но ставят под сомнение тот факт, что у этих авторов действительно были данные о микробиоме эндометрия (более правдоподобно, что их выводы были сделаны на основании оценки цервикальной микрофлоры). Интересным и неожиданным результатом нашего исследования является связь между более высоким альфа-разнообразием и вероятностью наступления беременности в протоколах ЭКО: 2 показателя разнообразия (индексы Шеннона и эквитабельности) выявили статистически значимые различия между женщинами с положительными и отрицательными результатами переноса эмбрионов. При этом, по нашему мнению, необходимо провести дальнейшие исследования по оценке биоразнообразия микробиоты эндометрия и его роли в реализации фертильности.
Наконец, данные использования мультиплексной ПЦР в режиме реального времени (фемофлор 16) указывают на то, что этот метод не совсем подходит для анализа образцов эндометрия, но при этом способен подтвердить различия между вагинальными и эндометриальными колонизирующими микроорганизмами.
Заключение
Наши данные подтвердили эффективность использования двухпросветных зондов с цанговым механизмом для тестирования микробиома эндометрия, что создает новые перспективы как для изучения его биоразнообразия, так и для определения его роли в рецептивности эндометрия и, соответственно, женской фертильности.
Список литературы
1. Базанов П.А., Кузнецова И.А., Павлухина С.С., Горская О.С., Митюшина Н.Г. Эффективность программ вспомогательных репродуктивных технологий у пациенток с хроническим эндометритом после лечения путем нормализации локальной экспрессии факторов врожденного иммунитета. Проблемы репродукции. 2020;26(5):8690. https://doi.org/10.17116/repro20202605186
2. Benner M, Ferwerda G, Joosten I, van der Molen RG. How uterine microbiota might be responsible for a receptive, fertile endometrium. Hum Reprod Update. 2018;24(4):393-415. https://doi.org/10.1093/humupd/dmy012
3. Agostinis C, Mangogna A, Bossi F, Ricci G, Kishore U, Bulla R. Uterine Immunity and Microbiota: A Shifting Paradigm. Front Immunol. 2019;10:2387. https://doi.org/10.3389/fimmu.2019.02387
4. Глухова Е.В., Шаховская И.Н. Микробиологическая характеристика биотопов репродуктивного тракта при эндометрите. Тольяттинский медицинский консилиум. 2021;1(2):38-44. eLIBRARY ID: 20808469
5. Hashimoto T, Kyono K. Does dysbiotic endometrium affect blastocyst implantation in IVF patients? J Assist Reprod Genet. 2019;36(12):2471-2479. https://doi.org/10.1007/s10815-019-01630-7
6. Булгакова В.П., Боровиков И.О. Применение препаратов микронизированного натурального прогестерона при подготовке к проведению вспомогательных репродуктивных технологий у пациенток с маточным фактором бесплодия. Проблемы репродукции. 2018;24(6):6775. https://doi.org/10.17116/repro20182406167
7. O'Callaghan JL, Turner R, Dekker Nitert M, Barrett HL, Clifton V, Pelzer ES. Re-assessing microbiomes in the low-biomass reproductive niche. BJOG. 2020;127(2):147-158. https://doi.org/10.1111/1471-0528.15974
8. Altmäe S, Rienzi L. Endometrial microbiome: new hope, or hype? Reprod Biomed Online. 2021;42(6):1051-1052. https://doi.org/10.1016/j.rbmo.2021.05.001
9. Molina NM, Sola-Leyva A, Haahr T, Aghajanova L, Laudanski P, et al. Analysing endometrial microbiome: methodological considerations and recommendations for good practice. Hum Reprod. 2021;36(4):859-879. https://doi.org/10.1093/humrep/deab009
10. Кисель Е.И. Современные возможности оценки состояния эндометрия при хроническом эндометрите (обзор литературы). Международный журнал прикладных и фундаментальных исследований. 2016;(4):698-702. eLIBRARY ID: 25779224
11. Al-Nasiry S, Ambrosino E, Schlaepfer M, Morré SA, Wieten L, et al. The Interplay Between Reproductive Tract Microbiota and Immunological System in Human Reproduction. Front Immunol. 2020;11:378. https://doi.org/10.3389/fimmu.2020.00378
12. Moreno I, Codoñer FM, Vilella F, Valbuena D, Martinez-Blanch JF, et al. Evidence that the endometrial microbiota has an effect on implantation success or failure. Am J Obstet Gynecol. 2016;215(6):684-703. https://doi.org/10.1016/j.ajog.2016.09.075
13. Chakravorty S, Helb D, Burday M, Connell N, Alland D. A detailed analysis of 16S ribosomal RNA gene segments for the diagnosis of pathogenic bacteria. J Microbiol Methods. 2007;69(2):330-9. https://doi.org/10.1016/j.mimet.2007.02.005
14. Chen C, Song X, Wei W, Zhong H, Dai J, et al. The microbiota continuum along the female reproductive tract and its relation to uterine-related diseases. Nat Commun. 2017;8(1):875. https://doi.org/10.1038/s41467-017-00901-0
15. Munro MG, Critchley HO, Broder MS, Fraser IS; FIGO Working Group on Menstrual Disorders. FIGO classification system (PALM-COEIN) for causes of abnormal uterine bleeding in nongravid women of reproductive age. Int J Gynaecol Obstet. 2011;113(1):3-13. https://doi.org/10.1016/j.ijgo.2010.11.011
16. Блесманович А.Е., Алехина А.Г., Петров Ю.А. Хронический эндометрит и репродуктивное здоровье женщины. Главный врач Юга России. 2019;2(66):46–51. eLIBRARY ID: 38525134
17. Cardellicchio L, Reschini M, Paffoni A, Guarneri C, Restelli L, et al. Frozen-thawed blastocyst transfer in natural cycle: feasibility in everyday clinical practice. Arch Gynecol Obstet. 2017;295(6):1509-1514. https://doi.org/10.1007/s00404-017-4383-z
18. Benaglia L, Busnelli A, Biancardi R, Vegetti W, Reschini M, et al. Oocyte retrieval difficulties in women with ovarian endometriomas. Reprod Biomed Online. 2018;37(1):77-84. https://doi.org/10.1016/j.rbmo.2018.03.020
19. Heravi FS, Zakrzewski M, Vickery K, Hu H. Host DNA depletion efficiency of microbiome DNA enrichment methods in infected tissue samples. J Microbiol Methods. 2020;170:105856. https://doi.org/10.1016/j.mimet.2020.105856
20. Маринкин И.О., Трунченко Н.В., Волчек А.В., Агеева Т.А., Никитенко Е.В. и др. Маркеры воспаления в нормальном и тонком эндометрии при хроническом эндометрите. Акушерство и гинекология. 2018;2:65-73. https://doi.org/10.18565/aig.2018.2.65-73
21. Liu Y, Ko EY, Wong KK, Chen X, Cheung WC, et al. Endometrial microbiota in infertile women with and without chronic endometritis as diagnosed using a quantitative and reference range-based method. Fertil Steril. 2019;112(4):707-717.e1. https://doi.org/10.1016/j.fertnstert.2019.05.015
22. Carosso A, Revelli A, Gennarelli G, Canosa S, Cosma S, et al. Controlled ovarian stimulation and progesterone supplementation affect vaginal and endometrial microbiota in IVF cycles: a pilot study. J Assist Reprod Genet. 2020;37(9):2315-2326. https://doi.org/10.1007/s10815-020-01878-4
23. Verstraelen H, Vilchez-Vargas R, Desimpel F, Jauregui R, Vankeirsbilck N, et al. Characterisation of the human uterine microbiome in non-pregnant women through deep sequencing of the V1-2 region of the 16S rRNA gene. PeerJ. 2016;4:e1602. https://doi.org/10.7717/peerj.1602
24. Qiu T, Liu L, Zhou H, Sheng H, He Y, et al. Analysis of endometrial microbiota in intrauterine adhesion by high-throughput sequencing. Ann Transl Med. 2021;9(3):195. Erratum in: Ann Transl Med. 2021;9(14):1216. PMID: 33708822; PMCID: PMC7940878. https://doi.org/10.21037/atm-20-2813.
25. Franasiak JM, Werner MD, Juneau CR, Tao X, Landis J, Zhan Y, et al. Endometrial microbiome at the time of embryo transfer: next-generation sequencing of the 16S ribosomal subunit. J Assist Reprod Genet. 2016;33(1):129-36. https://doi.org/10.1007/s10815-015-0614-z
26. Tao X, Franasiak JM, Zhan Y, Scott III RR, Rajchel J, et al. Characterizing the endometrial microbiome by analyzing the ultra-low bacteria from embryo transfer catheter tips in IVF cycles: Next generation sequencing (NGS) analysis of the 16S ribosomal gene. Human Microbiome Journal. 2017;3:15-21. https://doi.org/10.1016/j.humic.2017.01.004
Об авторах
И. И. КуценкоРоссия
Куценко Ирина Игоревна – доктор медицинских наук, профессор, заведующая кафедрой акушерства, гинекологии и перинатологии.
Краснодар
Конфликт интересов:
Нет
И. О. Боровиков
Россия
Боровиков Игорь Олегович - доктор медицинских наук, доцент, доцент кафедры акушерства, гинекологии и перинатологии.
Краснодар
Конфликт интересов:
Нет
Е. И. Кравцова
Россия
Кравцова Елена Иосифовна – кандидат медицинских наук, доцент, доцент кафедры акушерства, гинекологии и перинатологии.
Краснодар
Конфликт интересов:
Нет
В. П. Булгакова
Россия
Булгакова Вера Павловна - аспирант кафедры акушерства, гинекологии и перинатологии.
Краснодар
Конфликт интересов:
Нет
О. И. Боровикова
Россия
Боровикова Ольга Игоревна - аспирант кафедры акушерства, гинекологии и перинатологии.
Краснодар
Конфликт интересов:
Нет
Р. В. Черемных
Россия
Черемных Рушана Вадимовна - аспирант кафедры акушерства, гинекологии и перинатологии, Кубанский государственный медицинский университет.
Краснодар
Конфликт интересов:
Нет
А. А. Андреева
Россия
Андреева Анастасия Александровна - аспирант кафедры акушерства, гинекологии и перинатологии.
Краснодар
Конфликт интересов:
Нет
М. И. Боровиков
Россия
Боровиков Максим Игоревич – студент.
Краснодар
Конфликт интересов:
Нет
Рецензия
Для цитирования:
Куценко И.И., Боровиков И.О., Кравцова Е.И., Булгакова В.П., Боровикова О.И., Черемных Р.В., Андреева А.А., Боровиков М.И. Вагинальный и эндометриальный микробиом: оценка, влияние на имплантацию эмбриона. Медицинский вестник Юга России. 2023;14(3):5-15. https://doi.org/10.21886/2219-8075-2023-14-3-5-15
For citation:
Kutsenko I.I., Borovikov I.O., Kravtsova E.I., Bulgakova V.P., Borovikova O.I., Cheremnykh R.V., Andreeva A.A., Borovikov M.I. Vaginal and endometrial microbiome: evaluation, effect on embryo implantation. Medical Herald of the South of Russia. 2023;14(3):5-15. (In Russ.) https://doi.org/10.21886/2219-8075-2023-14-3-5-15






































